400-0931-005
13519671376

UDI是什么意思?
医疗器械唯一标识(Unique Device Identification,简称UDI)由产品标识和生产标识组成,能够为每个医疗器械产品赋予唯一的“数字身份证”,实现生产、经营、使用各环节的透明化、可视化,提升产品的可追溯性,是医疗器械监管手段创新和监管效能提升的重要抓手,对确保公众用械安全有着积极且重要的意义。
根据相关要求,2022年6月1日起生产的第三类医疗器械,应当具有医疗器械唯一标识。
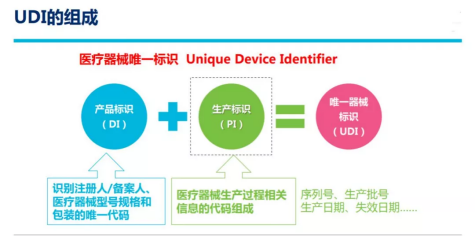
UDI系统由UDI识别符、UDID数据库和AIDC数据载体构成。UDI识别符由DI 和PI 两部分组成。
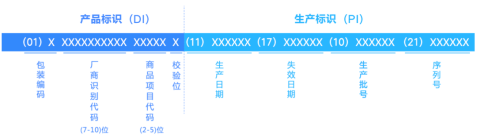
产品标识(DI)
产品标识属于静态信息,是器械产品的身份标识,包括识别注册人/备案人、医疗器械型号规格和包装的唯一代码。
生产标识(PI)
生产标识属于动态信息,用于标识医疗器械产品的生产信息,包括序列号、批号、生产日期和有效期等,其与DI联合使用才能指向特定的医疗器械产品。
医疗器械唯一标识管理信息系统(UDID)
医疗器械唯一标识数据库“UDID”由国家药品监督管理局组织建立,并制定医疗器械唯一标识数据相关标准及规范,以供公众查询。医疗器械唯一标识管理信息系统主要用于医疗器械产品标识(UDI-DI)及相关信息的申报管理,具有UDI-DI维护、变更、管理等功能。
AIDC数据载体
UDI数据载体是存储和(或)传输医疗器械唯一标识的数据媒介。器械UDI载体应当满足机器识别(AIDC)和人眼可读(HRI)的要求,可采用一维条码、二维条码或者RFID电子标签等形式。
根据国家药监局制定的《医疗器械唯一标识系统规则》(以下简称《规则》)要求:
注册人/备案人应当在申请医疗器械注册、注册变更或者办理备案时,在注册/备案管理系统中提交其产品标识。
注册人/备案人应当在产品上市销售前,将产品标识和相关数据上传至医疗器械唯一标识数据库。
UDI为何如此重要?
减少医疗差错;简化将器械使用信息集成到数据系统的操作,识别出现不良事件的医疗器械;更加迅速地为已报告的问题制定解决方案,实现重点突出且有效的安全沟通;安全访问明确器械标识信息的原始来源。
未按要求执行,重罚!
另外,从2022年5月1日开始执行的新版《医疗器械生产监督管理办法》中,也对医疗器械唯一标识工作做出明确规定:
医疗器械注册人、备案人、受托生产企业应当按照国家实施医疗器械唯一标识的有关要求,开展赋码、数据上传和维护更新。
未按照国家实施医疗器械唯一标识的有关要求,组织开展赋码、数据上传和维护更新等工作的,由药品监督管理部门依职责责令限期改正;拒不改正的,处1万元以上5万元以下罚款;情节严重的,处5万元以上10万元以下罚款。
医疗器械经营企业应当按照国家有关规定执行医疗器械唯一标识制度,应当建立并实施产品追溯制度,保证产品可追溯。
此前,医疗器械在流通使用环节无码或者一物多码现象普遍,严重影响了医疗器械生产、流通、使用等各环节对医疗器械的精准识别,难以实现有效监督和管理。
但在医疗器械“实名制”全面落地后,则有望实现“一械一码一身份”,从源头生产、经营流通、到临床使用各环节“一码联通”。
一旦出现产品违规,就可以通过UDI自动识别并精准追踪到所属企业,以此来倒逼生产企业在生产和销售的过程中严格把控质量。
溯源难题解决后,医疗器械厂家、经销商们迎来的会是更严格的监管!做好产品的质量把控,对自己的产品负责,尤为重要。

多省发文
明确唯一标识实施范围
目前,医疗器械唯一标识工作的的进度已经到了最后的紧急实施阶段,多省积极发文响应加快推进医疗器械唯一标识工作。
除第三类医疗器械外,海南、福建、四川、北京、天津等省市第二类医疗器械均陆续开展医疗器械唯一标识工作;
福建、甘肃等省份也已经上线了UDI编码维护功能,要求相关企业登陆阳光采购平台维护医用耗材UDI编码;
甘肃更是规定2022年6月1日以后生产的第三类医疗器械须提供唯一标识信息后方可纳入省平台参与招标采购,无唯一标识信息的,不得进行采购和使用!